

Projekta nosaukums: „Melanomas atjaunošanās bioloģija pēc mērķētas terapijas pielietošanas pret BRAF mutāciju”
Projekts tiek veikts Eiropas Reģionālā attīstības fonda (ERAF) 1.1.1.1. pasākuma “Praktiskas ievirzes pētījumi” 2. kārtas ietvaros.
Projekta identifikācijas Nr.: 1.1.1.1/18/A/099
Projekta izpildes termiņš: 2019. gada 1. marts – 2022. gada 28. februāris
Projekta kopējais finansējums: 648 648,00 EUR
Projekta zinātniskais vadītājs: Dr. biol. Dace Pjanova
Projekta kopsavilkums:
Metastātiskā melanoma, kas rodas pēc sākotnēji veiksmīgas mērķterapijas, ir sāpīga problēma gan medicīnā, gan sabiedrībā kopumā, galvenokārt, slimnieku augstās mirstības dēļ. Šajā projektā tiks pētīta mejozes loma B-RAF mutētās melanomas rezistences attīstībā pret mērķterapiju un tās iespējamie mehānismi. Projekta hipotēze ir, ka B-RAF melanomas mutācija ektopiski aktivē mejozes cikla daļu. Tiek aktivēti mejotiskie un CTA (CTCFL-MAGE A grupas) proteīni, kas modulē Ras-Raf-MEK-ERK proliferācijas signālceļu, izraisot mejozei-līdzīgu mitotisku arestu un “mitotisko izslīdēšanu” (‘mitotic slippage’), procesā iesaistot arī audzēju supresora Hippo signālceļu un tādejādi tetraploidīju ar pārprogramēšanu. Tas savukārt, noved pie tā, ka mēŗķterapija veic rezistentas sub-populācijas izvairīšanos no G1-aresta un nāves un ļauj izdzīvot pēc depoliploidizācijas mazai šūnu proporcijai, kas veido klonus. Šis modulētais šūnas cikls, dēvēts arī par “mejomitozi”, ir maz pētīts un var radīt jaunas zināšanas un iespējas melanomas patoģenēzes pētījumos. Hipotēzes tiks pārbaudīta gan in vitro melanomas šūnu kultūrās, gan pacientu materiālā. Fundamentālā projekta mērķis ir aplūkot šo mehānismu kā koncepcijas pierādījumu, meklējot iespējamus jaunus terapeitiskos mērķus, vienlaikus piesaistot zinātnei jaunus cilvēkus un palielinot BMC zinātnisko izcilību.
Informācija publicēta 01.03.2019.
Projekta progress:
2019. gada 1. marts – 2019. gada 31. maijs
Projekta sākuma fāzē tika pētīta vēža triploīdijas izcelsme, izmantojot Mitelmana datubāzē pieejamās 15 ļaundabīgo un piecu labdabīgo audzēju kariotipu paraugkopas no vīriešu dzimuma pacientiem (kopā 2928 kariotipi). In silico meta-analīze parādīja, ka kariotipu heterogenitāte ar izteiktu triploīdo frakciju novērojama visos ļaundabīgo audzēju tipos. Savukārt X hromosomas disomija (visbiežāk novērojama kā XXY kariotips) pozitīvi korelēja ar triploīdiju, negatīvi korelēja ar diploīdiju un nekorelēja ar tetraploīdiju. Lai precizētu šos datus, ir iesākta in silico analīze kas balstās uz eksomu sekvenēšanas datiem. Paralēli BMC pieejamajos primārās melanomas audos un no tiek izveidotajās primārajās melanomas šūnu līnijās tika noteikts BRAF V600 mutācijas statuss, izmantojot konvenciālo Sangera sekvenēšanu. Mutācija tika atrasta piecās primārajās melanomās un vienā izveidotajā primārās melanomas šūnu līnijā, kas bija arī trīskārši pozitīva uz melanomai specifiskiem marķieriem noteiktiem ar RT-PCR metodi. Minētā kultūra kā klīniskais materiāls tiks izmantota turpmākajās analīzēs.
Informācija ievietota 31.05.2019.
Projekta progress:
2019. gada 1. jūnijs – 2019. gada 31. augusts
Žurnālā “Gene” (Basel) nopublicēta meta-analīze par audzēju triploīdiju, ieskaitot melanomu. Pārbaudīta SK-MEL 28 šūnu līnijas genotoksiskā rezistence izmantojot jonizējoso apstarojumu. Noskaidrots, ka šīs šūnu līnijas rezistence ir ļoti augsta – šūnas izdzīvo un veido klonus pat pēc 30 Gy trieciena. Ar imunocitoķīmiju palīdzību pamanīta mitotiskā noslīdēšana.
Informācija ievietota 30.08.2019.
Projekta progress:
2019. gada 1. septembris – 2019. gada 30. novembris
Papildus meta-analīzei par vīriešu audzēju triploīdiju XXY žurnālā “Gene” (Basel), kas izcēla veselu genomu reorganizāciju, nopublicēts raksts par to iespējamo mehānismu (When Three Isn’t a Crowd: A Digyny Concept for Treatment-Resistant, Near-Triploid Human Cancers. Salmina et al., 2019; Genes (Basel). 2019 Jul 19;10(7)). SK-MEL28 melanomas šūnu līnijā uzsākti BRAF inhibitora (vemurafenib) devas un to ietekme uz rezistences attīstību un morfoloģiski atšķirīgu šūnu veidošanos pētījumi. Paralēli notiek DNS izdalīšana no formalīnā fiksētiem parafīnā ieslēgtiem melanomas audiem BRAF un NRAS mutāciju noteikšanai melanoma pacientos.
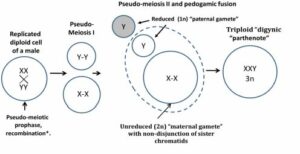
1. attēls. Konceptuāla tripoīdijas veidošanās shēma vīriešu audzējos.
Informācija ievietota 29.11.2019.
Projekta progress:
2019. gada 1. decembris – 2020. gada 29. februāris
Sagatavots un iesniegts raksts “Mitotic slippage and extranuclear DNA in cancer chemoresistance: a focus on telomeres” (International Journal of Molecular Sciences). Šajā rakstā mēs izvirzām hipotēzi par alternatīvu telomēru pagarināšanos, kas saistīta ar homologo hromosomu rekombināciju un invertēto mejozi. Paralēli turpinās BRAF un NRAS mutāciju noteikšana pacientu formalīnā fiksētiem parafīnā ieslēgtiem melanomas audiem.
Informācija ievietota 28.02.2020.
Projekta progress:
2020. gada 1. jūnijs – 2020. gada 31. augusts
Sagatavota, iesniegta un akceptēta grāmatas ar nosaukumu “Melanoma” nodaļa “The role of the meiotic component in reproduction of B-RAF mutated melanoma: a review and “brain storming” session”. Tajā mēs apskatām mejotiskās šūnu dalīšanās iespējamos mehānismus melanomas šūnu un melanomas dzīves cikla attīstībā ietverot gan ģenētiskos, epiģenētiskos un evolucionāros aspektus un parādām, ka B-RAF un N-RAS onkogēnu izraisītās novecošanās pārvarēšana ir saistīta ar melanomas šūnu pārprogrammēšanu, kurā nozīmīgu lomu spēlē cancer testis (CT) antigēni un mejotiskie gēni. Papildus minēto gēnu iesaiste melanomas progresijā tiek parādīta arī bioinformātiskas analīzes veidā, kurā kā blīvi savienoto olbaltumvielu mijiedarbības tīkla galvenās sastāvdaļas parādās PRAME un MAGEA grupas antigēni primārās melanomas gadījumā un SPANX grupas antigēni melanomas progresijas gadījumā, visos gadījumos esot iesaistītiem arī klasiskajiem mejotiskajiem gēniem. Paralēli turpinās arī eksperimenti ar SK-MEL 28 melanomas šūnu līniju un B-RAF un N-RAS gēnu mutāciju analīze formalīnā fiksētajos parafīnā iestrādātajos pacientu melanomas audos.
Informācija ievietota 31.08.2020.
Projekta progress:
2020. gada 1. septembris – 2020. gada 30. novembris
Nopublicēta iepriekšējā atskaites periodā sagatavotā grāmatas nodaļa “The role of the meiotic component in reproduction of B-RAF mutated melanoma: a review and “brain storming” session” (“Melanoma” OpenInTech, 2020. doi: 10.5772/intechopen.93641). Publicēts arī raksts par melanomas pacientu klīniskajiem un audzēja histopatoloģiskajiem rādītājiem, kas saistīti ar melanomas progresiju un metastazēšanos – Pjanova D, Ruklisa D, Kregere E, Azarjana K, Ozola A, Cema I. Features associated with melanoma metastasis in Latvia. Oncol Lett. 2020 Oct;20(4):117. PMID: 32863930. doi: 10.3892/ol.2020.11978. Izmantojot sistēmabioloģijas pieeju analizēta poliploīdijas un bivalento gēnu loma audzējos, par ko iznāca publikācija – Anatskaya OV, Vinogradov AE, Vainshelbaum NM, Giuliani A, Erenpreisa J. Phylostratic Shift of Whole-Genome Duplications in Normal Mammalian Tissues towards Unicellularity Is Driven by Developmental Bivalent Genes and Reveals a Link to Cancer. Int. J. Mol. Sci. 2020, 21, 8759. https://doi.org/10.3390/ijms21228759.
Informācija ievietota 30.11.2020.
Projekta progress:
2020. gada 1. decembris – 2021. gada 28. februāris
Pārskata periodā analizēta mejotisko procesu klātbūtne melanomas šūnās un iespējamā korelācija ar BRAF gēna mutāciju statusu. Priekšeksperimentos parādīta sakarība starp BRAF mutāciju un palielinātu mitotisko šūnu skaitu šūnas cikla profāzē, kas vienlaikus korelē ar DNS pārrāvumu klātbūtni un samazinātu histona H3 ekspresiju. Tas norāda uz iespējamu “mitotisko izslīdēšanu” un iespējamu pāreju uz mejotisko profāzi, kuras laikā notiek DNS rekombinācijas. Šo hipotēzi apstiprina arī mejotisko gēnu ekspresijas klātbūtne analizētajās šūnās. Turpinās darbs pie šīs hipotēzes.
Informācija ievietota 26.02.2021.
Projekta progress:
2021. gada 1. marts – 2021. gada 31. maijs
Turpināts darbs pie mejotisko gēnu ekspresijas analīzes BRAF mutētās melanomās gan šūnu kultūrās, gan melanomas pacientu audos. Analizēta arī BRAF gēna mutāciju saistība ar melanomas histopatoloģiskajiem rādītājiem un limfocītu infiltrāciju audzējā, par ko sagatavota un iesniegta publikācija International Jounal of Oncology žurnālam.
Informācija ievietota 31.05.2021.
Projekta progress:
2021. gada 1. jūnijs – 2021. gada 31. augusts
Turpināts darbs pie gēnu ekspresijas atšķirību novērtēšanas BRAF mutētās un savvaļas tipa melanomas šūnās. Padziļināti pētīta “mitotiskā izslīdēšana” pēc melanomas šūnu apstrādes ar BRAF kināzes inhibitoru vemurafenib, paralēli izvērtējot senescences ierosināšanu un šūnu diferencēšanos apstrādes rezultātā. Turpināta analīze par BRAF gēna mutāciju saistība ar melanomas histopatoloģiskajiem rādītājiem un limfocītu infiltrāciju audzējā.
Informācija ievietota 31.08.2021.
Projekta progress:
2021. gada 1. septembris – 2021. gada 30. novembris
Nopublicēts raksts: Zablocka T, Nikolajeva A, Kreismane M, Pjanova D, Isajevs S “Addressing the importance of melanoma tumor-infiltrating lymphocytes in disease progression and clinicopathological characteristics” Mol Clin Oncol. 2021 Dec;15(6):255. doi: 10.3892/mco.2021.2417; Epub 2021 Oct 8. Turpinās darbs pie melanomas šūnu senescences, diferencēšanās, kā arī mejotiskās komponentes izpētes pēc Vemurafenib apstrādes.
Informācija ievietota 30.11.2021.
Projekta progress:
2021. gada 1. decembris – 2022. gada 28. februāris
B-RAF mutācijas rezultātā ierosinātie mejotiskie un poliploidizācijas procesi turpināja darboties arī pēc melanomas šūnu apstrādes ar b-raf kināzes inhibitoru vemurafenibu. Taču pārbaudītajos eksperimentālajos apstākļos šie procesi nebija dominējošie. Nozīmīgāku lomu melanomas rezistencē pret pielietoto mērķterapiju spēlēja replikatīvais stress. Paralēli tam tika novērota pārejoša melanomas šūnu diferencēšanās, iespējams, pateicoties pārejošai šūnu dalīšanās apturēšanai šūnas cikla G1 fāzē. Minētais mehānisms nākotnē varētu kalpot jaunas eksperimentālas pieejas izveidei arī klīnikā, kur terapijas rezistence varētu tikt pārvarēta ierosinot mazdiferencētu melanomas šūnu diferencēšanos, kam turpinājumā sekotu audzēja šūnu bojāeju.
Informācija ievietota 28.02.2021.

